Cad is dé -ocsaíd tíotáiniam ann?
Is é TiO2 an phríomhghné de dhé -ocsaíd tíotáiniam, atá ina lí ceimiceach neamhorgánach tábhachtach i bhfoirm solad bán nó púdar bán. Tá sé neamhthocsaineach, tá ard-bháine agus gile ann, agus meastar gurb é an lí bán is fearr é chun an bháine ábhair a fheabhsú. Úsáidtear é go forleathan i dtionscail ar nós bratuithe, plaistigh, rubair, páipéar, dúch, criadóireacht, gloine, etc.

Ⅰ.Léaráid slabhra tionscail dé -ocsaíd tíotáiniam:
(1.
(2) Tagraíonn an lár srutha do tháirgí dé -ocsaíde tíotáiniam.
(3) Is é an t -iar -réimse an réimse iarratais ar dhé -ocsaíd tíotáiniam.Úsáidtear dé -ocsaíd tíotáiniam go forleathan i réimsí éagsúla amhail bratuithe, plaistigh, déanamh páipéir, dúch, rubar, etc.

Ⅱ. Struchtúr criostail dé -ocsaíd tíotáiniam :
Is cineál cumaisc pholaitiúil é dé -ocsaíd tíotáiniam, a bhfuil trí fhoirm chriostal choitianta ann i nádúr, eadhon Anatase, rutile agus brookite.
Baineann rutile agus anatase le córas criostail tetragánach, atá cobhsaí faoi ghnáthteocht; Baineann Brookite le córas criostail orthorhombic, le struchtúr criostail éagobhsaí, mar sin is beag luach praiticiúil atá aige sa tionscal faoi láthair.

I measc na dtrí struchtúr, is é an chéim rutile an ceann is cobhsaí. Athróidh céim Anatase go neamh -inchúlghairthe go céim rutile os cionn 900 ° C, agus athróidh céim Brookite go neamh -inchúlghairthe go céim rutile os cionn 650 ° C.
(1) Céim Tíotáiniam Céim Rutile
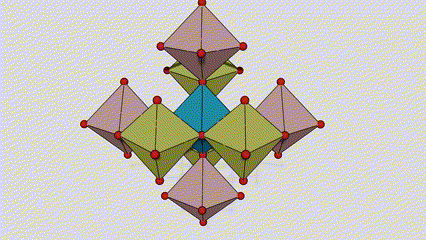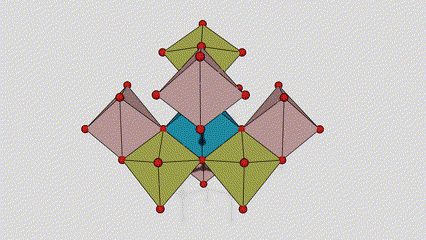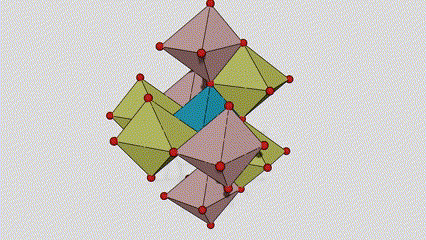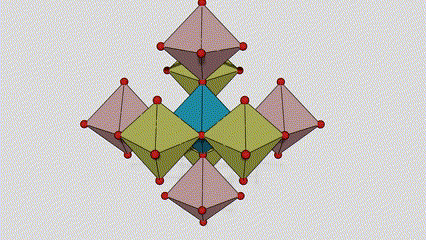
I ndé-ocsaíd tíotáiniam chéim rutile, tá adaimh TI suite i lár an laitíse criostail, agus tá sé adamh ocsaigine suite ag coirnéil an tíotáiniam-ocsaigin octahedron. Tá gach Octahedron ceangailte le 10 Octahedons máguaird (lena n -áirítear ocht n -imill comhroinnte agus dhá imill comhroinnte), agus cruthaíonn dhá mhóilín TiO2 cill aonaid.
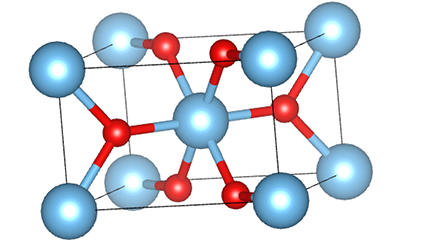
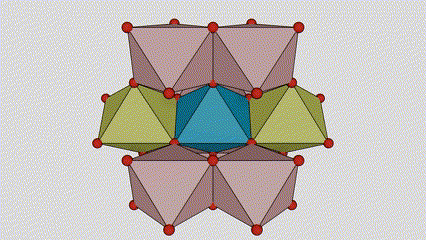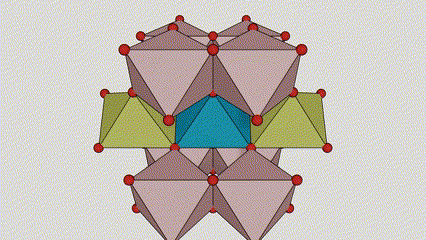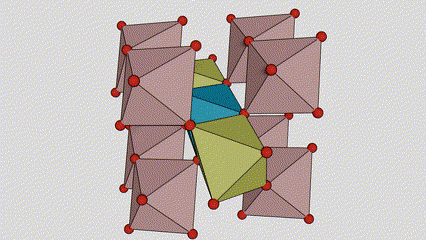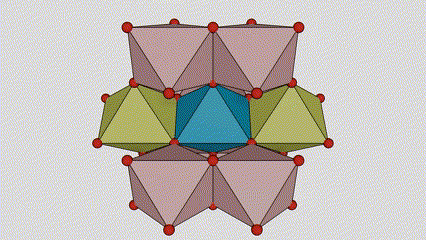
Léaráid sceidealta de chill criostail de dhé -ocsaíd tíotáiniam chéim rutile (ar chlé)
An modh nasctha le ocsaíd ocsaíd tíotáiniam (ar dheis)
(2) Céim Anatase Tíotáiniam Tíotáiniam
I ndé-ocsaíd tíotáiniam chéim Anatase, tá gach octahedron tíotáiniam-ocsaigine ceangailte le 8 n-octahedrons máguaird (4 imill comhroinnte agus 4 rinn comhroinnte), agus cruthaíonn 4 mhóilín TiO2 cill aonaid.
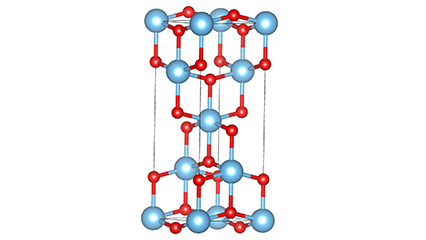
Léaráid sceidealta de chill criostail de dhé -ocsaíd tíotáiniam chéim rutile (ar chlé)
An modh nasctha le ocsaíd ocsaíd tíotáiniam (ar dheis)
Ⅲ. Modhanna um Dhí -Ocsaíd Tíotáiniam:
Áirítear go príomha le próiseas táirgthe dé -ocsaíd tíotáiniam próiseas aigéid sulfarach agus próiseas clóirínithe.

(1) Próiseas aigéid sulfarach
Is éard atá i gceist leis an bpróiseas aigéad sulfarach de tháirgeadh dé -ocsaíde tíotáiniam ná imoibriú aigéad -púdar tíotáiniam iarainn le haigéad sulfarach tiubhaithe chun sulfáit tíotáiniam a tháirgeadh, a dhéantar a hidrealú ansin chun aigéad metatitanic a tháirgeadh. Tar éis calcination agus brúite, faightear táirgí dé -ocsaíde tíotáiniam. Is féidir leis an modh seo dé -ocsaíd tíotáiniam agus tíotáiniam rutile a tháirgeadh.
(2) Próiseas clóirínithe
Is éard atá i gceist leis an bpróiseas clóirínithe a bhaineann le táirgeadh dé-ocsaíde tíotáiniam ná púdar slaig rutile nó ard-titanium a mheascadh le cóc agus ansin clóirínithe ardteochta a dhéanamh chun teitreaclóiríd tíotáiniam a tháirgeadh. Tar éis ocsaídiúcháin ardteochta, faightear an táirge dé-ocsaíde tíotáiniam trí scagachán, níochán uisce, triomú, agus brú. Ní féidir leis an bpróiseas clóirínithe de tháirgeadh dé -ocsaíde tíotáiniam ach táirgí rutile a tháirgeadh.
Conas barántúlacht dé -ocsaíd tíotáiniam a idirdhealú?
I. Modhanna Fisiceacha:
(1)Is é an modh is simplí ná an uigeacht a chur i gcomparáid le teagmháil. Mothaíonn dé -ocsaíd tíotáiniam falsa níos fusa, agus mothaíonn dé -ocsaíd tíotáiniam fíor níos gaire.

(2)Trí shruthlú le huisce, má chuireann tú roinnt dé -ocsaíd tíotáiniam ar do lámh, is furasta an ceann bréige a ní, cé nach bhfuil sé furasta an ceann fíor a ní.

(3)Tóg cupán uisce glan agus scaoil dé -ocsaíd tíotáiniam isteach ann. Tá an ceann a shnámhann an dromchla fíor, agus tá an ceann a shocraíonn an bun falsa (ní fhéadfaidh an modh seo a bheith ag obair le haghaidh táirgí gníomhachtaithe nó modhnaithe).
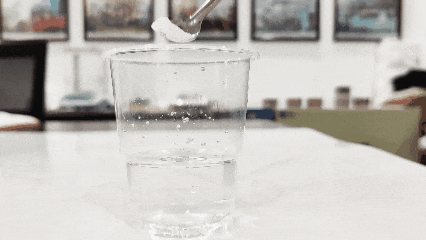

(4)Seiceáil a intuaslagthacht in uisce. Go ginearálta, tá dé -ocsaíd tíotáiniam intuaslagtha in uisce (ach amháin i gcás dé -ocsaíd tíotáiniam atá deartha go sonrach le haghaidh plaistigh, dúigh, agus roinnt dé -ocsaíd tíotáiniam sintéiseach, atá dothuaslagtha in uisce).

Ii. Modhanna ceimiceacha:
.

.

(3) Má tá an sampla hidreafóbach, ní bheidh imoibriú ina chúis le haigéad hidreaclórach a chur leis. Mar sin féin, tar éis é a fhliuchadh le eatánól agus ansin aigéad hidreaclórach a chur leis, má tháirgtear boilgeoga, cruthaíonn sé go bhfuil púdar carbónáit cailciam brataithe sa sampla.

Iii. Tá dhá mhodh mhaithe eile ann freisin:
.
(2) Roghnaigh roisín trédhearcach, mar ABS trédhearcach le púdar dé -ocsaíd tíotáiniam 0.5% curtha leis. Tomhais a tharchur solais. Dá laghad an tarchur solais is é an púdar dé -ocsaíde tíotáiniam is barántúla.
Am Post: Bealtaine-31-2024





